«Pantouflage pharma» Des organes de régulation suisses sous influence?
Patrick Durisch et Gabriela Hertig, 22 mai 2025
Un conseiller fédéral qui rejoint, aussitôt son mandat terminé, les rangs d’une entreprise-phare dans le domaine de la construction, dont il était auparavant le ministre de tutelle. Une secrétaire d’État à l’économie (SECO) qui intègre, moins d’un an après avoir quitté ses fonctions officielles, le Conseil d’administration de Nestlé, multinationale dont elle a défendu les intérêts commerciaux en tant qu’ambassadrice et négociatrice en chef de la Suisse auprès d’instances internationales. Un vice-directeur de l’Office fédéral de la santé publique (OFSP), en charge de la division «Assurance maladie et accidents», qui devient sans délai le nouveau directeur général d’une caisse-maladie privée. Les passages de hauts cadres de l’administration publique ou de membres du gouvernement vers le secteur privé font parfois les gros titres, suscitant des inquiétudes légitimes sur les questions de conflits d’intérêts et d’indépendance des autorités.
Ce phénomène, connu sous le nom de pantouflage (revolving door en anglais), est-il une pratique marginale ou, au contraire, bien établie? Ne concerne-t-il que les cadres supérieur·e·s ou tous les niveaux hiérarchiques? Qu’en est-il du pantouflage inversé (ou reverse revolving door), ce passage moins scruté du secteur privé vers le public, mais tout autant susceptible de renforcer l’emprise des entreprises (corporate capture) sur les processus et structures politiques?
Pour répondre à ces questions, nous avons mené, avec l’appui du collectif de recherche WAV, une enquête inédite en Suisse. Le but: recenser des cas de «pantouflage pharma», c’est-à-dire entre l’industrie pharmaceutique – un secteur dont la force de frappe en matière d’influence politique et de lobbying a été largement documentée – et deux offices fédéraux impliqués dans la politique du médicament: Swissmedic et l’OFSP (voir notre méthodologie en fin d'article).
Pantouflage pharma «made in Switzerland»
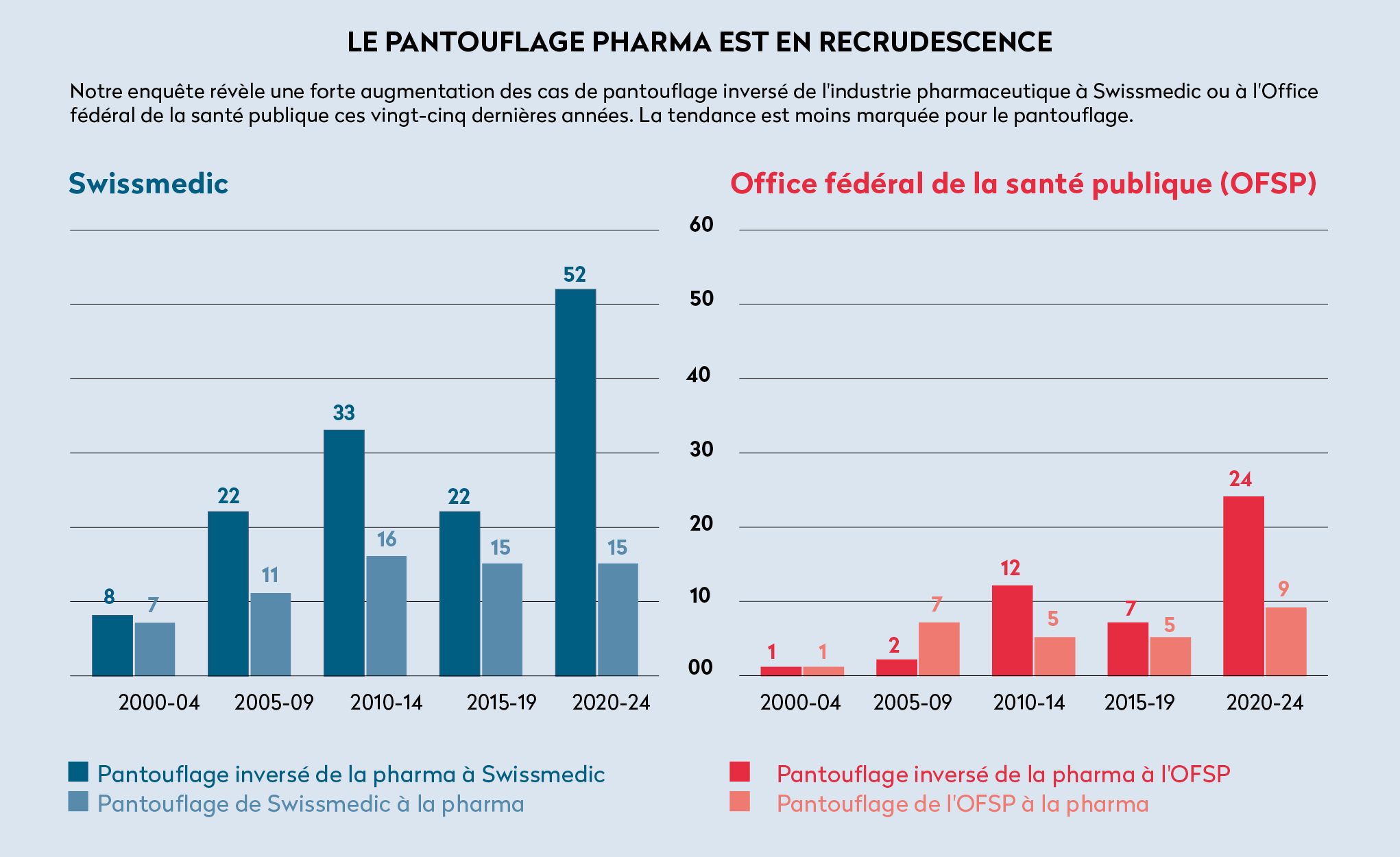
Notre enquête identifie 239 personnes impliquées dans au moins un épisode de pantouflage dans le secteur pharmaceutique. Par office fédéral, cela représente 173 personnes pour Swissmedic (23% des individus identifiés à l’Institut), et 66 personnes pour l’OFSP (4% des employé·e·s recensé·e·s) (voir le graphique ci-dessous).
Plus largement, sur les 741 personnes que nous avons identifiées comme ayant travaillé chez Swissmedic, 294 ont œuvré dans au moins une entreprise pharmaceutique – soit près de 40%, toutes fonctions confondues. Pour l’OFSP, dont la mission de santé publique dépasse largement la seule politique du médicament, ce taux est de 13% (201 sur 1 591 personnes identifiées).

Parmi les 239 personnes ayant pratiqué le pantouflage pharma, 43 (soit 18%) ont réitéré cette pratique au cours de leur carrière. Par exemple, cette personne qui, après cinq ans en charge des affaires règlementaires dans la pharma, travaille pendant dix-huit mois à Swissmedic comme examinatrice de dossiers d’homologation, puis passe dix-sept ans dans diverses grandes pharmas (dont Novartis) ainsi qu’un cabinet de conseil, toujours dans le même domaine, avant de revenir à un poste similaire à l’Institut pendant un an et demi pour finalement retourner dans ce même cabinet de conseil.
Au total, notre enquête identifie 208 épisodes de pantouflage pharma concernant Swissmedic et 76 concernant l’OFSP. Les deux tiers de ces épisodes ont eu lieu du privé vers le public (189 sur 284). Selon nos chiffres, le phénomène du pantouflage pharma est en recrudescence. En particulier, le pantouflage inversé, moins documenté, a fortement augmenté ces vingt-cinq dernières années (voir graphique).
Une partie de cette hausse peut être expliquée par l’essor du réseau LinkedIn, qui permet une meilleure identification des cas. Il n’explique cependant pas la baisse observée d’épisodes de pantouflage privé-public durant les années 2015 à 2019, suivie d’une hausse drastique de ceux-ci ces cinq dernières années.
Le pantouflage pharma concerne tous les niveaux hiérarchiques. Ainsi, sur les 239 personnes impliquées dans un ou plusieurs cas de pantouflage pharma:
- 26 (11%) étaient ou sont des dirigeant·e·s ou des cadres supérieur·e·s
- 204 (85%) occupaient ou occupent des positions ne figurant pas sur les organigrammes officiels (chef·fes de section, expert·es scientifiques, inspecteurs/inspectrices, conseil juridique, etc.)
- 9 (4%) étaient ou sont des expert·e·s mandaté·e·s par les offices fédéraux concernés. Ces personnes, pour lesquels les mesures en matière de conflits d’intérêts s’appliquent également, prennent position sur des décisions à venir (par exemple concernant l’homologation ou le prix de médicaments) ou sont membres de commissions extraparlementaires dont le sujet est en lien direct avec les tâches de Swissmedic ou de l’OFSP.
Des secteurs-clés exposés au pantouflage pharma
Certains domaines d’activités sont plus exposés que d’autres au pantouflage pharma. Pour les partisans des passages du privé au public, cette pratique se justifie par l’expertise pointue requise pour l’examen des dossiers d’homologation et la surveillance du marché, qui ne pourrait être acquise que dans le secteur pharmaceutique. Ce raisonnement minimise le risque de conflits d’intérêt et ignore l’expertise des milieux académique et médical.
Les enjeux commerciaux liés à la régulation des médicaments offrent un autre éclairage – qui fait écho au lobbying intense exercé par la branche pharmaceutique pour lever les obstacles règlementaires. Notre enquête identifie plusieurs secteurs-clés de la régulation du médicament particulièrement concernés par le pantouflage:
- Le secteur Autorisation de mise sur le marché (AMM) de Swissmedic, avec 90 personnes (52% de celles impliquées dans du pantouflage entre la pharma et l’Institut).
On peut, par exemple, citer le cas de cette personne que nous avons identifiée, nommée responsable du secteur à Swissmedic après plus de neuf ans en tant que conseillère et directrice médicale dans une grande pharma. Ou celui de ce cadre, qui après dix-huit ans au sein de diverses pharmas (dont Sandoz et Roche) est devenu responsable du secteur à Swissmedic, avant de rejoindre Novartis comme responsable de la conformité (compliance).
L’octroi d’une autorisation de mise sur le marché représente un enjeu majeur pour l’industrie, car elle conditionne la commercialisation d’un médicament et le début des entrées financières. Un délai de son octroi peut signifier un manque à gagner de l’ordre de plusieurs millions de francs pour le fabricant. C’est la raison pour laquelle la pharma fait pression pour des procédures d’AMM accélérées, qui sont en augmentation.
- Le secteur Autorisations & surveillance de Swissmedic – comprenant les divisions «Essais cliniques», «Inspections» et «Médicaments de thérapie innovante» – avec 52 personnes (30%).
On peut citer le cas de cet analyste, responsable des essais cliniques durant quinze ans dans diverses pharmas (dont Novartis), qui rejoint la division de Swissmedic comme collaborateur scientifique, où il reste plus de deux ans, avant de repartir vers une grande pharma en tant que directeur associé. Ou encore celui de cette personne qui, après quinze ans passés au sein de diverses pharmas, dirige la régulation des médicaments de thérapie innovante à Swissmedic.
Les essais cliniques sont un passage obligé pour prouver l’efficacité et la sûreté d’un nouveau médicament en vue d’obtenir une homologation. Un défaut constaté lors d’une inspection ou des données jugées trop peu robustes peuvent coûter cher. Quant aux médicaments de thérapie innovante, ils comprennent les produits de thérapie cellulaire (comme l’anticancéreux Kymriah de Novartis) et de thérapie génique, un domaine en plein essor avec un système de régulation encore récent.
- L’unité de direction Assurance maladie & accident de l’OFSP – comprenant la division «Médicaments» – avec 30 personnes (45% de celles impliquées dans du pantouflage entre la pharma et l’OFSP).
Par exemple, ce pharmacien avec dix ans à son actif dans une grande pharma en tant que spécialiste des affaires règlementaires, qui rejoint la division «Médicaments» de l’OFSP durant un an et demi, avant de repartir vers l’un des leaders mondiaux en biotechnologie. Ou encore cet ancien responsable de l’unité, également vice-directeur de l’OFSP, qui dès la fin de son mandat fonde son propre cabinet d’avocat et conseille plusieurs pharmas sur des affaires règlementaires.
La fixation du prix des médicaments est une étape-clé pour la pharma car les tarifs décidés par l’OFSP ont un impact direct sur la marge de profit.
Notre enquête identifie également des cas de pantouflage dans d’autres secteurs d’intérêt pour la pharma, comme la législation des produits thérapeutiques et de recherche sur l’être humain (OFSP), les maladies transmissibles (notamment durant la période Covid, OFSP), l’accès aux données des patient·es (OFSP), ou encore l’harmonisation de la règlementation de médicaments (Swissmedic).
Questionnés, Swissmedic et l’OFSP répondent être conscients des risques de conflits d’intérêts liés au pantouflage mais ne commentent pas les résultats de notre enquête, indiquant ne tenir aucune statistique sur le sujet.
Swissmedic souligne que les décisions d’octroi d’autorisations ou d’inspections se prennent en équipe, où interviennent différents niveaux hiérarchiques. Les cadres doivent en outre réaffirmer leur adhésion au code de conduite chaque année, les autres employé·e·s tous les deux ans. En réponse à nos questions, Swissmedic ne fournit aucun détail sur l’application des mesures en cas de pantouflage et renvoie aux dispositions législatives existantes (voir ci-dessous), qu’il déclare valables pour l’ensemble du personnel. L’autorité précise avoir amélioré ses règlements après un audit de 2020 du Contrôle fédéral des finances. Swissmedic rappelle enfin qu’il dépend de la connaissance approfondie de personnes issues de l’industrie pharmaceutique pour remplir sa mission, pour qui c’est un « soulagement » de disposer au sein des autorités de régulation de personnel «qui comprend son point de vue».
L’OFSP souligne que les personnes disposant de hautes compétences techniques et de connaissances approfondies du système de santé suisse sont «particulièrement recherchées» et nécessaires à sa mission. Des règles, comme un code de conduite contraignant et les dispositions législatives en vigueur, sont en place pour minimiser les conflits d’intérêts, rappelle l’administration, sans donner de détails sur leur mise en pratique à son niveau. L’Office rappelle également que les règles existantes sont applicables pour tous les types de pantouflage, y compris pour les passages du privé au public, mais déclare que les délais de carence ne peuvent être prévus que pour les fonctions dirigeantes.
Des mesures insuffisantes et peu transparentes
Le phénomène du pantouflage n’est pas nouveau. Ses risques en matière de conflits d’intérêts, d’emprise des entreprises, de corruption et de rupture de confiance envers les autorités ainsi que de distorsion de la concurrence sont connus depuis longtemps.
«En Suisse, les passages entre l'administration publique et le secteur privé, également appelés pantouflage, sont relativement fréquents», analyse Urs Thalmann, directeur de Transparency International Suisse. «Même si ces passages peuvent aussi présenter des avantages dans l’intérêt public, les risques de partialité, d'accès illégitime aux informations des autorités et de prises d’influence sont réels.» Selon lui, «ils devraient être contrés par des règles proportionnées, claires et appliquées de manière cohérente, comme des délais de carence, et ce, particulièrement pour les changements entre des autorités de régulation et des entreprises du secteur privé sous leur surveillance.»
La Suisse a tardé à mettre en place des mesures pour minimiser les risques liés au pantouflage. Il aura fallu une évaluation menée en 2007 par le Groupe d’États contre la corruption du Conseil de l’Europe (GRECO), recommandant notamment de règlementer le phénomène, pour que le Conseil fédéral demande fin 2008 la création d’un Groupe de travail interdépartemental pour la lutte contre la corruption (GTID Corruption). Plus récemment, le Conseil fédéral s’est doté d’une stratégie contre la corruption 2021-2024, dont le renouvellement est attendu sous peu.
Avec des mesures comme l’obligation de maintenir le secret des affaires, la récusation en cas de partialité, la possibilité d’un délai de carence à certaines catégories de personnel – soit une durée de temps minimale entre la fin du mandat public et la prise de fonction dans le secteur privé – et l’attribution à un autre poste moins exposé en cas de conflits d’intérêts, la Suisse a pris de premières dispositions législatives pour encadrer ce phénomène. Du fait de son statut d’administration fédérale décentralisée, Swissmedic dispose de ses propres règles d’application en la matière, sans mention explicite d’un délai de carence (voir ci-dessus).
Plus d'informations
-
La régulation du pantouflage en Suisse
Dans les années 2000, la Suisse a adhéré à plusieurs instruments internationaux destinés à la lutte contre la corruption – un domaine qui recoupe les prises illégales d’intérêts dont le pantouflage – comme la Convention anti-corruption de l’Organisation de coopération et de développement économiques (OCDE, 2000), la Convention pénale contre la corruption du Conseil de l’Europe (2006) qui a institué le Groupe d’États contre la corruption (GRECO) et la Convention des Nations Unies contre la corruption (CNUCC, 2009).
Pourtant, la Suisse a tardé à mettre en place des mesures concrètes pour minimiser les risques de conflits d’intérêts et de prises d’influence liés au pantouflage. Il aura fallu une évaluation menée par le GRECO en 2007, mettant en lumière les carences de la législation suisse et recommandant notamment de règlementer le pantouflage, pour que le Conseil fédéral demande fin 2008 la création d’un Groupe de travail interdépartemental pour la lutte contre la corruption (GTID Corruption). Plus récemment, le Conseil fédéral s’est doté d’une stratégie contre la corruption 2021-2024, dont le renouvellement pour la période 2025-2028 est attendue sous peu.
Une série de mesures destinées à mieux encadrer le pantouflage parmi le personnel de l’administration fédérale centrale (OFSP et SECO) existe dans la loi sur le personnel de la Confédération (LPers) et son ordonnance. Parmi celles-ci, on dénombre:
Une obligation de garder le secret sur les affaires de service y compris après la fin du rapport de travail (Art. 22 LPers / Art. 94 OPers) – le code pénal prévoit également une disposition concernant la violation du secret de fonction (Art. 320 CP);
La récusation en cas de risque de partialité (Art. 20 LPers / Art. 94a OPers);
La possibilité d’instaurer un délai de carence de six à douze mois à certaines catégories de personnel (essentiellement les très hauts cadres) après la fin des rapports de travail (Art. 94b OPers);
- L’interdiction pour les employé·e·s d’utiliser des informations non publiques dont ils ont eu connaissance dans l’exercice de leur fonction (Art. 20 LPers / Art. 94c OPers).
La Confédération a également édicté un Code de comportement, dont la version révisée de 2024 reprend certains de ces éléments mais qui est valable uniquement pour le personnel de l’administration fédérale centrale (OFSP notamment).
Par son statut d’administration fédérale décentralisée, Swissmedic dispose de ses propres règles d’application en la matière. Celle-ci se trouvent dans l’Ordonnance sur le personnel de Swissmedic ainsi que dans le code de conduite Swissmedic (qui est contraignant puisque faisant partie intégrante du contrat de travail), valables aussi bien pour le personnel que pour les expert·e·s mandaté·e·s par l’Institut.
Outre un devoir de diligence et de fidélité (Art. 43), l’obligation de maintenir le secret de fonction/professionnel/des affaires (Art. 45), d’autorisation pour toute activité accessoire (Art. 46) et le devoir de récusation en cas de conflit d’intérêts (Art. 48), l’ordonnance prévoit aussi un devoir des employé·e·s d’annoncer tout départ dans une pharma et la possibilité de mesures (récusation, attribution à une autre fonction ou la libération des fonctions) visant à éviter les conflits d’intérêts (Art. 44). Cet aspect est repris dans le code de conduite (art. 18), en précisant que ces mesures concernent tout particulièrement «la Directrice ou le Directeur, ainsi que les membres de la Direction et les collaborateurs à l’influence déterminante sur des décisions importantes dans le cadre d'autorisations et de contrôles». Il n’y a toutefois aucune mention explicite de délai de carence.
Le délai de carence fait l’objet d’une ordonnance spécifique entrée en vigueur en 2016 (Ordonnance sur le délai de carence). Celle-ci définit les règles applicables en la matière aux cadres du plus haut niveau hiérarchique de l’administration fédérale, aux membres des organes de direction des établissements de la Confédération et aux membres des commissions extraparlementaires.
Pourtant, certaines de ces mesures, comme le délai de carence, ne sont pas encore assez ambitieuses pour agir efficacement contre le pantouflage et les conflits d’intérêts qui en résultent, comme l’ont récemment confirmé le GRECO (2024) ainsi qu’un audit du Contrôle fédéral des finances (2025).
Public Eye recommande la prise en compte des éléments suivants pour renforcer l’encadrement du pantouflage et garantir la primauté de l’intérêt public:
- Un délai de carence, aujourd’hui «possible», devrait devenir systématique. Le GTID Corruption a préconisé dès 2011 l’introduction d’une clause «anti-pantouflage» avec délai de carence dans les contrats de travail des cadres supérieur·e·s en cas de passage dans le secteur privé. Cette recommandation est pour l’heure restée lettre morte: un questionnaire adressé en 2019 au secrétariat général des sept départements a montré qu’une telle clause n'avait été intégrée contractuellement qu’à trois reprises depuis 2016. Aujourd’hui, le Conseil fédéral et le GTID Corruption rechignent à exiger une application plus large et systématique du délai de carence, en se réfugiant derrière la liberté économique des personnes concernées. Cette argumentation peine à convaincre.
- La durée du délai de carence devrait être de 12 mois au minimum pour que la mesure soit efficace. C’est aussi l’avis de l’ONU et du GRECO. Avec une durée de 6 à 12 mois maximum, la Suisse reste bien en-deçà de nombreux pays européens, qui prévoient des délais de carence allant jusqu’à 36 mois, du moins pour les hauts cadres de l’administration. L’ONG Transparency International recommande également une durée de 12-18 mois comme «minimum raisonnable».
- Le délai de carence devrait être appliqué plus largement. Aujourd’hui, il cible essentiellement les secrétaires d’État, directeurs d’office et secrétaires généraux des départements ainsi que leurs suppléant·es. Des membres de la direction de Swissmedic ou de l’OFSP autres que le directeur ou la directrice qui décideraient de rejoindre la pharma ne sont a priori pas concernés, alors que de tels transferts peuvent comporter un risque de conflit d’intérêt et de réputation pour l’administration fédérale. Les positions hiérarchiquement inférieures ne sont pas du tout visées, alors que certaines pourraient aussi faire passer les intérêts commerciaux de la pharma avant l’intérêt public.
- Le passage du privé vers le public devrait également être pris en compte dans la régulation et les mesures de contrôle. Les mesures se concentrent aujourd’hui sur les mouvements du public vers le privé. Or, notre recherche a identifié deux fois plus de cas de pantouflage pharma inversé. Il existe certes un devoir de se récuser, mais celui-ci repose sur le degré de transparence des conflits d’intérêts déclarés par l’employé·e et, pour beaucoup, sur une appréciation personnelle. Un examen plus systématique permettrait une meilleure identification des risques. Une interdiction plus formelle d’exercer certaines fonctions au sein de l’administration publique – comme le prévoient par exemple la France ou l’Italie dans leur législation – devrait aussi pouvoir être envisagée.
- Le pantouflage devrait être encadré de façon transparente. Le manque de transparence actuel ne permet pas de savoir si des mesures concrètes sont prises, et dans quelles proportions. Dans un rapport de 2018, le Contrôle fédéral des finances a par exemple estimé que la clause sur le pantouflage a certes été intégrée à la législation sur le personnel de la Confédération, mais qu’elle «n’est pas mise en œuvre en pratique». Qu’en est-il aujourd’hui? Impossible de le savoir. Davantage de transparence sur le phénomène du pantouflage en Suisse «comme mesure démocratique élémentaire», c’était aussi la demande d’une motion au Conseil National en 2023 suite au passage de l’ancienne cheffe du SECO chez Nestlé.
Les autorités doivent agir
Notre enquête montre que la pratique du pantouflage entre l’industrie pharmaceutique et des organismes publics régulateurs du marché des médicaments est courante en Suisse. Cette proximité soulève des inquiétudes légitimes quant à l’indépendance de nos autorités de régulation, en particulier lorsque ces mouvements de personnel ne sont pas suffisamment encadrés. Le mode de financement de Swissmedic, dont environ 80% du budget provient de la pharma, soulève par ailleurs déjà en soi des suspicions de partialité.
Tous les cas de pantouflages ne comportent pas les mêmes risques, et il serait illusoire de vouloir interdire ce phénomène, ne serait-ce que pour des questions constitutionnelles de liberté économique des personnes. Certains transferts en provenance de la pharma peuvent même s’avérer bénéfiques en matière d’expertise technique, pour autant que des mesures solides soient prises pour éviter tout risque de conflit d’intérêts et de prise d’influence.
Or aujourd’hui, il est impossible de savoir si les mesures d’encadrement prévues par la législation sont systématiquement appliquées, et à quelle échelle. Davantage de transparence est nécessaire pour préserver l’indispensable confiance de la population envers les autorités. Des mesures de sensibilisation, telles que prévues dans la stratégie de lutte contre la corruption, ne suffiront pas. Les autorités helvétiques doivent rendre compte d’actes concrets.
Si le pantouflage n’est pas suffisamment encadré et régulé, une entité comme Swissmedic risquerait de devenir un agent de promotion économique plutôt qu’une agence de régulation d’intérêt public.
Plus d'informations
-
Méthodologie
Public Eye a mandaté le collectif de recherche WAV pour collecter et compiler des données permettant de documenter des cas de pantouflage (revolving door) ou de pantouflage inversé (reverse revolving door) entre l’industrie pharmaceutique et trois offices fédéraux concernés par la politique du médicament: Swissmedic, l’Office fédéral de la santé publique (OFSP) et le secrétariat d’État à l’économie (SECO).*
À l’aide d’un compte LinkedIn «Premium Business», le collectif WAV a élaboré manuellement une liste de personnes ayant indiqué Swissmedic, l’OFSP ou le SECO comme leur actuel ou ancien employeur sur leur profil (au 01.08.2024), avec leur parcours professionnel.
Le collectif WAV a ensuite complété cette liste par le biais de trois autres sources:
- L’annuaire fédéral (www.staatskalender.admin.ch), qui fournit des données sur le personnel actuel de l’administration fédérale.
- Les organigrammes des dix dernières années (2013-2024), sollicités par Public Eye auprès des trois offices fédéraux concernés.
- Une recherche complémentaire sur internet pour compléter le parcours professionnel des personnes ne disposant pas de profil LinkedIn.
Toutes les informations récoltées ont été compilées manuellement dans une base de données qui comprend 3118 personnes.
Public Eye a analysé cette base de données pour identifier les cas de pantouflage pharma, avec les critères suivants:
- La personne a travaillé au moins un an au sein d’une pharma ainsi qu’au moins un an dans l’office fédéral concerné.
- Le passage de l’un à l’autre est direct.
- Par «pharma», on entend des entreprises (1) impliquées dans la R&D, la production et la mise sur le marché de médicaments commerciaux (2) membres d’une association faîtière défendant les intérêts commerciaux de la branche (par ex. Interpharma ou Intergenerika) (3) proposant des conseils et services dans le domaine du droit pharmaceutique, de la R&D pharma ou des affaires règlementaires.
Ne sont pas considérés comme «pantouflage pharma» tous les passages directs de ou vers des caisses-maladies, des entités de distribution (pharmacies, grossistes), des laboratoires d’analyses/de diagnostics, des sociétés spécialisées dans les dispositifs médicaux, les médicaments vétérinaires, la médecine complémentaire ou naturelle, les compléments alimentaires, les cosmétiques.
*En raison du mandat multisectoriel du SECO et de la faible pertinence des résultats (cinq cas de pantouflages pharma), ces derniers n’ont pas été retenus dans l’analyse.
Cette enquête se base notamment sur les données de profils LinkedIn, qui constituent des déclarations individuelles et qui peuvent ne pas être à jour. Ces limitations ont été atténuées en recoupant une partie des informations avec les autres sources.

